
Soigner l’addiction par la stimulation cérébrale profonde

Les chercheurs explorent l’utilisation de courant électrique de faible intensité sur des zones spécifiques du cerveau pour traiter l’addiction, une technique déjà utilisée pour la maladie de Parkinson...
Le cerveau est parcouru en permanence par des signaux électriques générés par l’activité des neurones. Leur amplitude va de quelques micro à quelques millivolts et leur gamme de fréquence s’étend de quelques dixièmes d’Hertz à plus de 100 Hertz (1 Hertz = 1 oscillation par seconde). À l’état de veille, lorsqu’une information est analysée, les neurones d’une région impliquée dans la réalisation d’une tâche spécifique travaillent chacun pour leur propre compte. L’activité électrique est alors peu synchronisée et de moyenne amplitude, caractérisant les ondes beta (13-30 Hertz). À l’inverse, lors du sommeil profond, donc en l’absence d’informations à traiter, les activités oscillatoires de différentes régions sont synchronisées, générant l’onde delta de faible amplitude (<4 Hertz).
Illustration vidéo : simulation de l’activité électrique du cerveau - Crédit : Neuroscape, UCSF.
Les altérations de fonctionnement des neurones et les troubles de leur synchronisation sont associés à plusieurs pathologies neurologiques ou psychiatriques, parmi lesquelles la maladie de Parkinson. Cette pathologie est due principalement à une dégénérescence progressive des neurones à dopamine de la substance noire, région du cerveau située au niveau du tronc cérébral. La désorganisation de l’activité électrique, et plus spécifiquement une augmentation des ondes beta des neurones du noyau subthalamique, a pour conséquence la survenue de tremblements de repos et d’une akinésie (retard à l'initiation des mouvements) qui caractérisent la maladie. Des travaux de recherche ont montré que le fait de délivrer des impulsions électriques à haute fréquence dans le noyau subthalamique permettait de réguler l’activité neuronale, de la synchroniser, et de faire disparaître les tremblements. Le mécanisme exact de ces améliorations n’est pas encore connu.
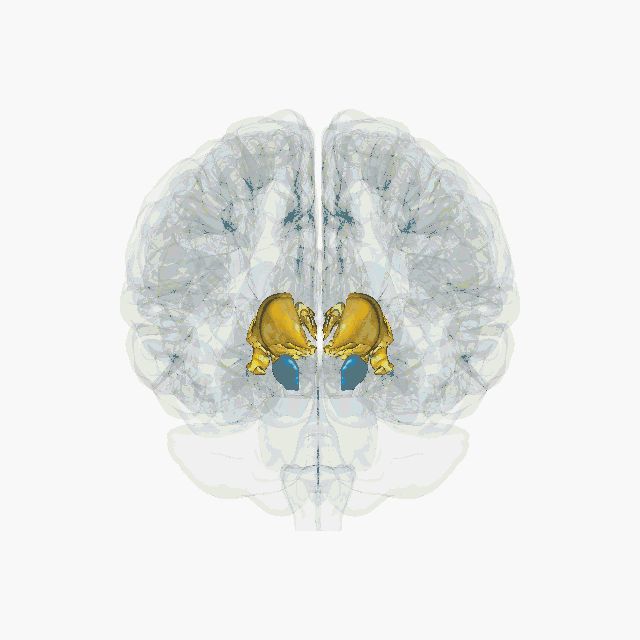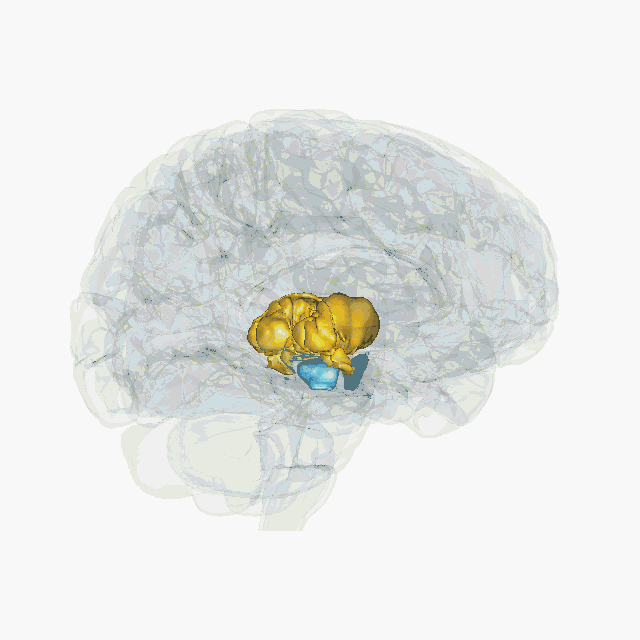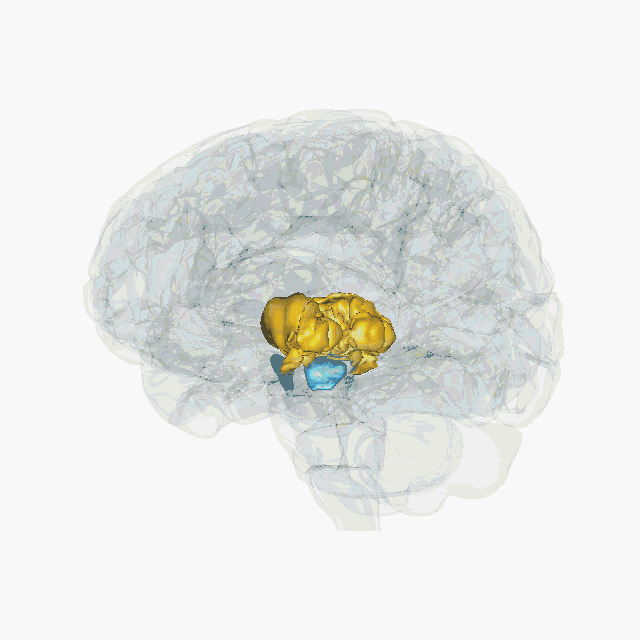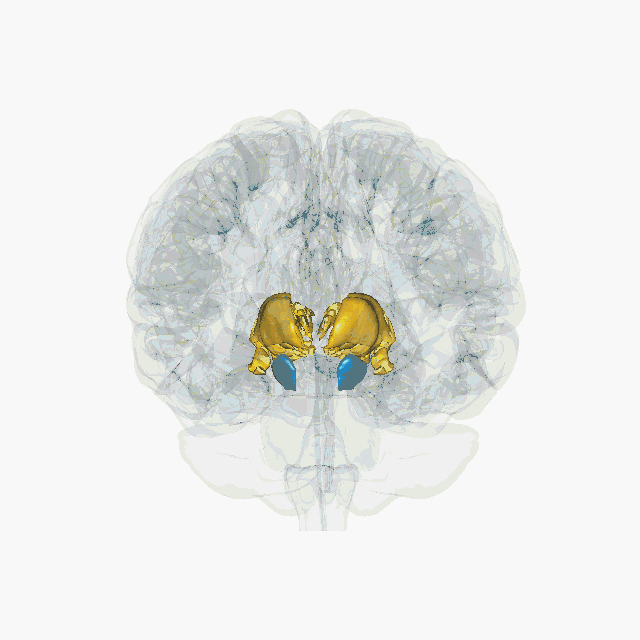
Cette technique s’appelle la stimulation électrique cérébrale profonde. Elle n’a rien à voir avec les électrochocs (ou électroconvulsivothérapie) qui envoient un courant électrique sur le cuir chevelu pour déclencher une crise d’épilepsie. On parle ici de stimulation profonde car elle permet d’agir directement dans des régions ciblées au cœur du cerveau. Elle est devenue un outil thérapeutique proposé en cas de maladie de Parkinson sévère avec complications. Elle consiste à délivrer un courant électrique de faible voltage (entre 2 et 4 volts) dans le noyau subthalamique via une électrode implantée chirurgicalement. L’électrode est reliée par un fil sous-cutané à un générateur (pacemaker) placé sous la peau, au niveau de la clavicule. Cette technique présente l'intérêt d'être réversible et a donc motivé des chercheurs et chercheuses à imaginer comment elle pourrait être utilisée pour d’autres pathologies.
Dans le cas des pathologies psychiatriques, l’effet de ce traitement a été évalué au cas par cas sur différentes structures cérébrales cibles avec des résultats variés. En ce qui concerne les addictions, les premières observations d'amélioration ont été faites chez des patients qui étaient traités pour des troubles obsessionnels compulsifs, des dépressions sévères ou le syndrôme Gilles de la Tourette chez qui on a observé, suite à la stimulation, une réduction de la consommation de tabac ou d'alcool.
Les études d’imagerie ont montré que l’addiction aux drogues était associée à un dysfonctionnement du circuit de la récompense, caractérisé, entre autres, par une diminution des récepteurs D2 à la dopamine dans le noyau accumbens. Aussi, les quelques expériences cliniques de traitement par stimulation électrique se sont focalisées sur cette zone. Toutefois, altérer le fonctionnement d’une structure directement impliquée dans la motivation risque non seulement de réduire la motivation pour les drogues, mais aussi pour toute autre activité. Le problème est le même pour toutes les structures du circuit de la récompense comme l’aire tegmentale ventrale, le cortex préfrontal, l’hippocampe, l’amygdale, le thalamus.
Une équipe de chercheurs à Marseille a montré que l’inactivation du noyau subthalamique chez le rat permettait de réduire la motivation pour la cocaïne tout en augmentant la motivation pour obtenir de la nourriture sucrée. Cette dissociation d'effet entre la drogue et la nourriture fait du noyau subthalamique une piste intéressante à considérer. En effet, ce noyau, longtemps considéré comme uniquement impliqué dans les phénomènes moteurs, participe également au contrôle de l’impulsivité, de la motivation et de la récompense.
Récemment, ils ont mené des expérimentations sur des rats ayant perdu le contrôle de leur consommation de cocaïne. L’objectif était d’évaluer les modifications électriques survenant dans le noyau subthalamique au cours de l’escalade de la consommation de drogue ainsi que l’efficacité de la stimulation électrique pour réduire la consommation et éviter les rechutes.
Les rats avaient un cathéter implanté dans la veine jugulaire pour l’administration de cocaïne et une électrode introduite chirurgicalement dans le noyau subthalamique. Celle-ci permettait d’une part de mesurer l’activité électrique et, d’autre part, de délivrer des impulsions électriques de faible intensité à haute-fréquence (130 Hz). Les rats étaient mis dans une cage où ils pouvaient s’auto-administrer de la cocaïne en appuyant sur un levier. Chaque session durait d'abord 2 heures pendant l'acquisition du comportement d'auto-administration de drogue, puis 6 heures pendant la phase d'escalade de la consommation. Du fait de son pouvoir addictif la consommation de cocaïne augmentait régulièrement au cours de l'accès prolongé à 6 heures.
Les résultats ont montré que les oscillations de basse à moyenne fréquence (beta) du noyau subthalamique augmentaient pendant la période d’escalade de consommation de cocaïne, étape précédant l’installation de l’addiction. Les chercheurs ont montré qu'en empêchant les oscillations de se développer par l’envoi régulier d’ondes de haute fréquence pendant toute la session où les rats étaient exposés à la cocaïne, ils pouvaient bloquer cette escalade de consommation. Une fois cet effet préventif démontré, il restait à tester le potentiel thérapeutique de cette approche chirurgicale. Un autre groupe de rats a d'abord escaladé sa consommation de cocaïne, puis a été sevré pendant 1 mois et remis ensuite en présence de cocaïne. La stimulation à haute fréquence a permis de réduire l’intensité de la rechute. Des résultats similaires ont été obtenus par cette équipe en collaboration avec une équipe américaine sur des rats exposés non pas à la cocaïne mais à l’héroïne.
Dans la perspective d’une utilisation de cette technique thérapeutique chez les sujets addicts, cela imposerait de maintenir la stimulation en permanence et ce chaque fois que le sujet est confronté à une situation où le désir de consommer est présent. Et comme ce désir peut se manifester des mois voire des années après le sevrage complet, le dispositif devrait rester en place pendant longtemps.
Des progrès restent donc à faire pour que cette approche thérapeutique puisse être proposée en pratique.

Baunez
Christelle Baunez est Directrice de Recherche DR1 au CNRS, Directrice adjointe de l'Institut de Neurosciences de la Timone à Marseille et Directrice de l'équipe Ganglions de la Base, Motivation et Récompense (BaGaMoRe). Elle est titulaire d'un doctorat en neurosciences.

Nalpas
MD, PhD
Directeur de recherche émérite
Département Information Scientifique et Communication de l'Inserm






