
Un nano-interrupteur sur le récepteur de la nicotine

Grâce à l’optogénétique, la recherche en neurosciences dispose de moyens de plus en plus précis pour modifier et comprendre ce qui se passe au niveau des neurones : explications
Le tabac contient plus de 4000 molécules différentes mais celle qui est responsable de l’addiction au tabac est la nicotine. On estime que plus d’un milliard de personnes dans le monde sont dépendants au tabac. Les conséquences du tabagisme sont dramatiques avec, dans le monde selon les données de l’Organisation Mondiale pour la Santé, environ un décès toutes les 8 secondes par maladie liée au tabac. Sur les 7 millions de décès annuels, 6 millions concernent des consommateurs ou d'anciens consommateurs, et environ 890 000 des non-fumeurs involontairement exposés à la fumée.
Ne pas fumer du tout, ne pas expérimenter la cigarette est une attitude de protection de sa santé, mais lorsqu’on est devenu dépendant au tabac, arrêter de fumer peut se révéler être un véritable défi. Selon les enquêtes disponibles, seuls 0,5 à 3% des fumeurs qui tentent de s’arrêter seul de fumer seront encore abstinents au bout d’un an, ce pourcentage montant à environ 20% chez les sujets bénéficiant d’un soutien thérapeutique.
Mieux comprendre les mécanismes d’addiction à la nicotine afin de faciliter et solidifier le sevrage est donc un challenge majeur pour les chercheurs.
La nicotine se lie dans le cerveau aux récepteurs nicotiniques (nAChR), les mêmes que ceux auxquels se fixe l’acétylcholine (voir la vidéo Les effets de la nicotine sur le cerveau). Les récepteurs nicotiniques sont composés de 5 sous-unités codées par des gènes différents. Ces sous-unités, de type α ou β, s’assemblent en des combinaisons variables, les plus abondantes étant les sous-types α4β2 et α7. En se fixant sur ces récepteurs, la nicotine va activer les mêmes réseaux que l’acétylcholine, agir entre autres sur la mémoire et l’apprentissage, et également entraîner une libération de dopamine au niveau de l’aire tegmentale ventrale, phénomène qui participe largement à l’installation et au maintien de l’addiction. Toutefois, le fonctionnement global de ces récepteurs et les rôles respectifs de chacune des sous-unités de ces récepteurs dans la libération de dopamine n’étaient pas jusqu’alors totalement élucidés.
Pour avancer sur ce point, les chercheurs ont mis au point une méthode permettant d’interroger le fonctionnement du récepteur en agissant à la demande sur l’une des sous-unités le constituant : la sous-unité β2, fortement soupçonnée selon des résultats antérieurs d’être un des acteurs clé de la mise en place de l’addiction à la nicotine. La méthode utilisée est fondée sur la pharmacologie optogénétique. Cette technique consiste à intégrer dans le récepteur, à proximité du site où se lient les molécules, une molécule chimique dont la conformation spatiale peut être modifiée par une lumière de longueur d’onde définie et qui va ainsi agir comme un nano-interrupteur. En « allumant » une lumière violette de longueur d’onde 380 nm, l’interrupteur se replie et empêche la nicotine ou l’acétylcholine de se fixer au site de liaison, le récepteur est alors inactivé. Après extinction de la lumière, la molécule se déplie lentement et le site de liaison redevient accessible, le récepteur peut à nouveau être activé. Le processus de « dépliage » peut être accéléré par l’envoi d’une lumière verte de longueur d’onde 520 nm.
Les chercheurs ont dans un premier temps montré que l’activation du récepteur par la nicotine était bloquée par la lumière violette. En effet aucun signal électrique n’était détecté après stimulation par la nicotine mais il était rétabli après illumination par la lumière verte.
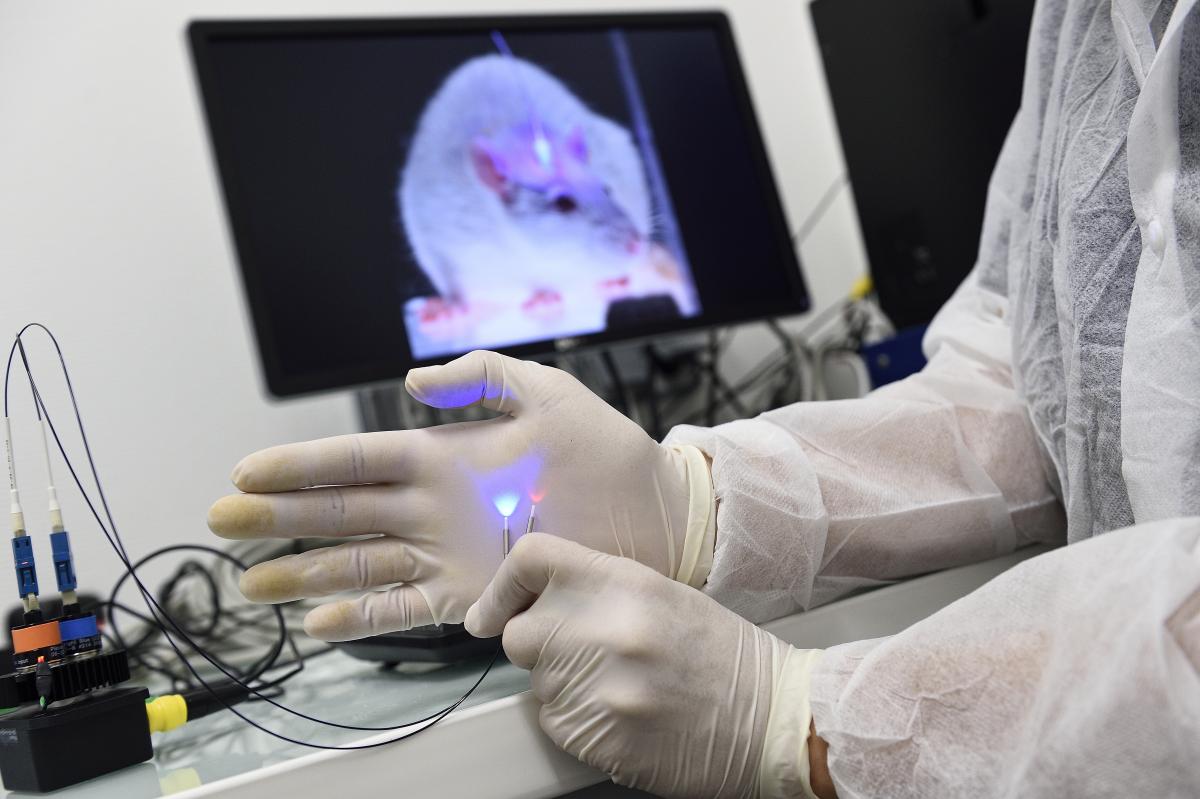
Crédit : Inserm/Delapierre, Patrick
Dans un deuxième temps, les chercheurs ont analysé les types d’activité électrique des neurones à dopamine de l’aire tegmentale ventrale. Des travaux ont effectivement distingué deux types d’activité électrique : une activité tonique, régulière et à basse fréquence, et une activité phasique, constituée de décharges transitoires à haute fréquence. Cette dernière est celle qui est associée aux comportements d’apprentissage par renforcement qui sont détournés dans l’addiction. Les résultats ont montré que suite à l’administration de nicotine, l’inactivation aigüe par la lumière violette de la sous-unité β2 diminuait sensiblement l’activité phasique des neurones à dopamine et que la réponse était restaurée par l’illumination par la lumière verte.
Enfin, dans une dernière expérience, les chercheurs ont étudié in vivo, en comportement, l’impact de la sous-unité β2 sur l’attrait pour la nicotine. Pour mesurer cet attrait, les souris étaient dans un espace qui pouvait être séparé en deux compartiments. Le premier jour les souris avaient accès libre à tout l’espace et le temps passé dans chaque compartiment était mesuré. Les 3 jours suivants, l’espace était séparé. Dans un côté les souris recevaient par injection de la nicotine et, de l’autre côté, elles recevaient une solution neutre, sans nicotine. Au 5ème jour, l’espace était à nouveau libre et il a été constaté que les souris passaient plus de temps dans le compartiment où elles avaient reçu la nicotine que dans l’autre. Cette association entre un lieu et un produit, appelée « préférence de place » signe le renforcement : la souris préfère le compartiment où elle a reçu le produit. Afin de contrôler avec la lumière ce comportement de préférence de place, une très fine canule contenant une fibre optique pour la conduction de lumière avait été implantée dans l’aire tegmentale ventrale d’une série de souris chez qui avait été greffé le nano-interrupteur sur le récepteur nicotinique. La même expérience a été répétée sur deux groupes de souris, en les soumettant, qu’elles reçoivent de la nicotine ou le liquide neutre, soit à la lumière violette soit à la lumière verte. Les résultats de ces expériences ont montré que les souris préféraient la nicotine lorsqu’elles la recevaient avec de la lumière verte, correspondant à une sous-unité β2 active dans l’aire tegmentale ventrale, et non lorsqu’elles la recevaient avec de la lumière violette (lorsque la sous-unité β2 était bloquée). Cela signifie que l’activation de la sous-unité β2 au niveau de l’aire tegmentale ventrale est nécessaire pour la mise en place des mécanismes comportementaux de renforcement à la nicotine, la première étape conduisant à l’addiction.
Ces travaux, bien que très fondamentaux, ouvrent de nouvelles pistes. D’une part, ils valident une technique qui permet d’analyser très finement l’impact d’une molécule, d’un médicament, sur un récepteur au niveau moléculaire mais également sur le comportement. D’autre part, ils identifient définitivement la sous-unité β2 du récepteur nicotinique comme un élément important de l’ensemble des mécanismes conduisant à l’addiction au tabac. Toutefois, pouvoir arrêter de fumer simplement en s’exposant à la lumière violette n’est pas encore pour demain !

Durand-de Cuttoli
Romain Durand-de Cuttoli est Docteur en Neurosciences, membre de l'équipe Neurophysiologie et Comportement (NPC) du laboratoire Neuroscience Paris-Seine de l'Institut de Biologie Paris Seine (UPMC UM CR18 – CNRS UMR 8246 – INSERM U1130) - http://faurelab.cnrs.fr/

Nalpas
MD, PhD
Directeur de recherche émérite
Département Information Scientifique et Communication de l'Inserm






