La neuro-inflammation liée à la consommation de drogues - 1ere partie

Selon les études en neurosciences, les drogues déclenchent une inflammation dans le cerveau et le système nerveux - 1ere partie : impact des différentes substances psychoactives
La neuro-inflammation est l'inflammation du cerveau et des neurones qui composent le système nerveux. Elle peut être déclenchée entre autres par :
- une infection (méningite par exemple),
- une blessure,
- des toxiques comme les substances psychoactives,
- ou encore le vieillissement.
La survenue d’un événement susceptible d’être dangereux pour le cerveau est détectée par une famille de récepteurs en permanence à l’affût, les PRR (Pattern-recognition receptors). L’activation de ces récepteurs va déclencher une cascade de signaux qui alertent de nombreuses cellules et particulièrement les astrocytes, les oligodendrocytes et les microglies. Ces cellules ont une fonction de support des neurones et une fonction immunitaire (voir aussi l'article Comment les substances psychoactives affectent l’immunité).
Les astrocytes, les oligodendrocytes et les microglies vont libérer des molécules appelées «médiateurs de l’inflammation». Ils peuvent être « pro-inflammatoires », c’est à dire déclencher l’inflammation ou « anti-inflammatoires ». Ils portent les noms de cytokine, lymphokine, interleukine (« kine » vient du grec « kinesis » signifiant mouvement). Leur fonction est d’éliminer les agents toxiques, infectieux ou non, et/ou de réparer les lésions causées. Ils agissent entre autres en régulant la libération de nombreux neurotransmetteurs dont le glutamate, le GABA, la dopamine. Lorsque le problème est contrôlé, la neuro-inflammation disparaît et tout rentre dans l’ordre. En revanche, si le problème persiste, la neuro-inflammation peut devenir toxique de par son ampleur et/ou sa chronicité.
De nombreux travaux ont montré que la microglie est un important régulateur de la plasticité synaptique. Elle peut modifier les éléments pré- et post-synaptiques, et donc la morphologie de la synapse, ce qui peut altérer les processus de potentialisation à long-terme, mécanisme majeur de la mémorisation (voir dossier Mémoire et substances psychoactives - 1). Comme la densité de microglie est particulièrement élevée dans l’hippocampe, il n’est pas étonnant que l’ensemble des connaissances sur la neuro-inflammation suggère fortement que celle-ci entraîne des troubles de la mémoire. Cela a été démontré sur des modèles animaux et chez des personnes atteintes de pathologies neuro-dégénératives comme la maladie d’Alzheimer.
Les données disponibles concernent majoritairement l’alcool, les amphétamines et la cocaïne. Les effets du cannabis, malgré leur potentiel anti-inflammatoire, ont été peu étudiés et ceux concernant la nicotine sont trop anciens, datant d’avant 2000, époque où les techniques d’investigations cérébrales étaient peu performantes.
L’ensemble des études disponibles démontre que l'exposition à l'alcool a un impact significatif sur le système neuro-immunitaire.
En effet des travaux au laboratoire utilisant des modèles animaux et des cerveaux humains post-mortem ont montré que l’alcool active directement les cellules microgliales, augmente l’expression des gènes qui codent différentes cytokines pro-inflammatoires, et diminue celle d’une cytokine anti-inflammatoire, ce qui augmente l’inflammation. Par ailleurs le métabolisme de l’alcool conduit à la synthèse de radicaux très réactifs qui vont, eux aussi, contribuer à l’hyperactivation des facteurs pro-inflammatoires (voir aussi l'article L’alcool est génotoxique). Enfin, plusieurs études ont montré que le taux de facteurs inflammatoires dans le sang était significativement augmenté chez les personnes ayant une consommation excessive d’alcool.
La neuro-inflammation déclenchée dans le cerveau par l’alcool peut être aggravée par l’inflammation qu’il engendre sur le tube digestif. En effet, l’alcool augmente la perméabilité de la paroi intestinale ce qui favorise le passage de molécules toxiques dans le sang et déclenche la production de facteurs pro-inflammatoires. Ceux-ci circulent dans le sang et peuvent pénétrer dans le cerveau.
La consommation excessive chronique d’alcool, par rapport à l’alcoolisation aiguë, pourrait avoir des effets différents sur la neuro-inflammation. En effet 3 études publiées en 2017 et 2018, menées chez des sujets dépendants à l’alcool, âgés en moyenne de 40 ans, montrent que l’inflammation de la microglie, évaluée par PET scan, était de 10 à 20% moins élevée dans l’hippocampe que chez les sujets témoins. Une corrélation inverse entre le degré d’inflammation et la sévérité de la dépendance ainsi que le nombre de verres par jour était observée dans un des travaux. Ces résultats contradictoires avec les effets décrits de l’alcool en consommation aiguë n’ont pas aujourd’hui trouvé d’explication. Des vérifications sont à mener chez les sujets dépendants car le nombre étudié dans chacune de ces 3 études était faible (respectivement 9, 15 et 19), et les techniques de neuroimagerie ont progressé.
L’amphétamine et ses dérivés comme la méthamphétamine (METH) activent la microglie, et augmentent la production de cytokines. L’activation de la microglie chez 12 usagers chroniques de METH et 12 sujets témoins a été étudiée par PET-scan dans un travail publié en 2008. Les sujets n’avaient pas consommé de METH depuis une durée allant de 6 mois à 4 ans. L’activité était significativement plus élevée dans le cerveau moyen (partie basse du cerveau), le striatum, le thalamus et le cortex orbito-frontal. L’augmentation d’activité n’était pas liée à la durée de consommation de METH, par contre elle était inversement corrélée à la durée d’abstinence. En clair, plus la durée d’abstinence était longue, moins l’activité de la microglie était élevée, mais elle restait toujours supérieure à celle des sujets témoins. Cela suggère que l’inflammation subsisterait de manière durable après l’arrêt du produit. Toutefois ce résultat doit être interprété avec prudence en raison du faible nombre de sujets étudiés.
Les effets de la cocaïne sur la neuro-inflammation sont similaires à ceux provoqués par l’alcool. Chez l'humain, la consommation chronique de cocaïne est associée à une augmentation des taux d’une cytokine pro-inflammatoire dans le sang et à une diminution d’une cytokine anti-inflammatoire, ce qui indique un effet pro-inflammatoire global.
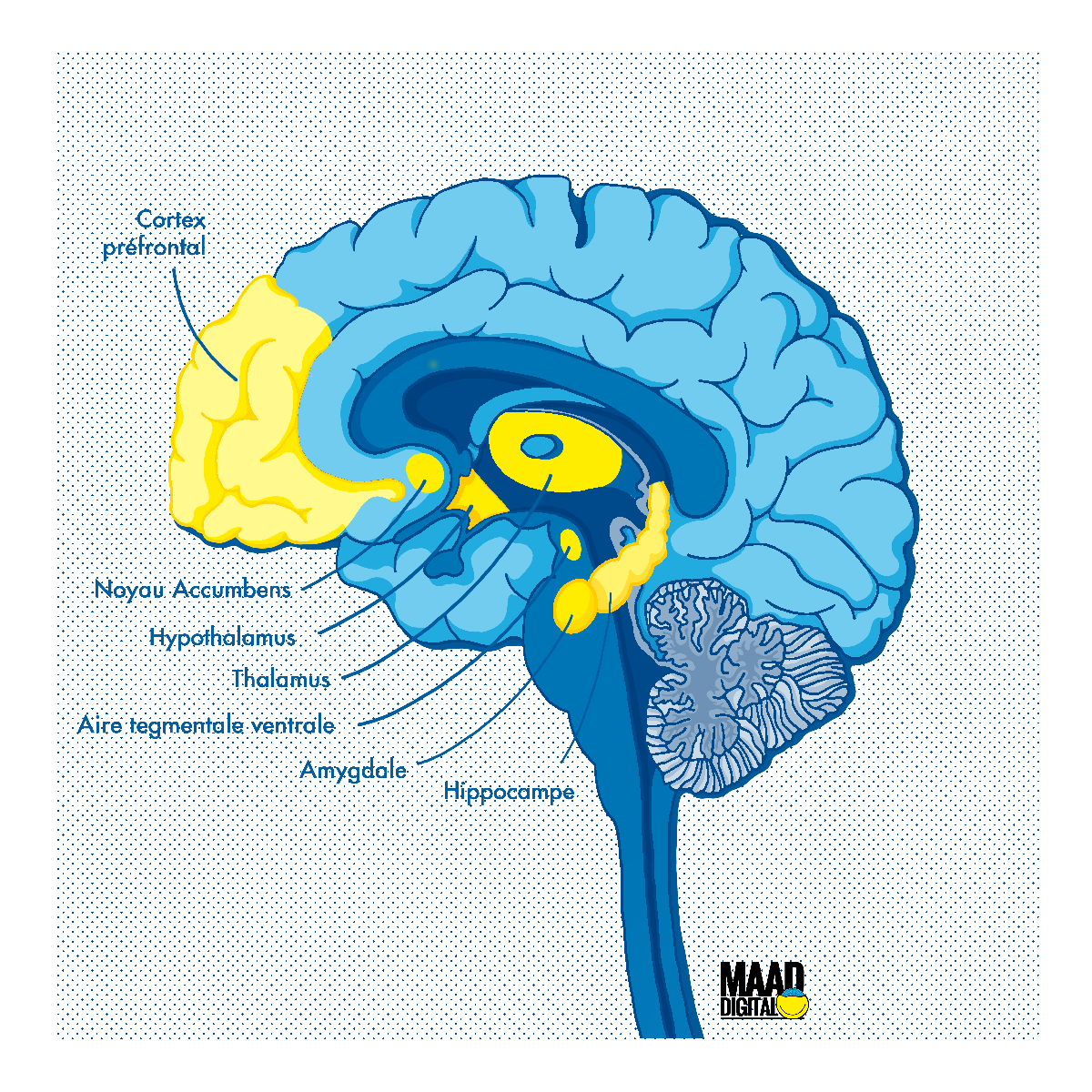
Le constat d’une neuro-inflammation a été validé par des études post-mortem de cerveaux d’usagers chroniques de cocaïne ayant montré une activation accrue de la microglie. Chez le rat, l’administration aiguë ou chronique de cocaïne augmente l’expression des gènes des facteurs d’inflammation dans les structures du système de récompense, comme le striatum, le noyau accumbens, le cortex-préfrontal, l’amygdale, l’aire tegmentale ventrale. Des modifications identiques ont été trouvées chez les primates rendus dépendants à la cocaïne.
Les données concernant l'activation microgliale chez les consommateurs de cannabis sont aujourd’hui manquantes. Toutefois de nombreux travaux démontrent que l’exposition aiguë aux cannabinoïdes (CBD, THC, CBN) peut réduire les réponses immunitaires des cellules , inhiber la production de cytokines et de chimiokines inflammatoires et diminuer les lésions cellulaires neuronales. Par exemple, les cannabinoïdes réduisent l'activation de la microglie dans les modèles de la maladie d'Alzheimer et réduisent l'apparition et la gravité de la sclérose en plaques dans les modèles animaux. Ces propriétés restent à vérifier chez l’être humain. En effet, chez les patients souffrant de sclérose en plaque, l’administration de THC n’a eu aucun effet sur le taux des marqueurs inflammatoires circulants.
En conclusion, la consommation de produits psychoactifs déclenche la neuro-inflammation et la maintient lorsqu’elle est régulière. Ce phénomène agit en amont des effets directs des produits sur le système de récompense. Les chercheurs se sont alors demandés si un traitement contre la neuro-inflammation pourrait contribuer positivement au traitement de l'addiction : à suivre dans la 2e partie de cet article La neuro-inflammation liée à la consommation de drogues - 2e partie

Nalpas
MD, PhD
Directeur de recherche émérite
Département Information Scientifique et Communication de l'Inserm






